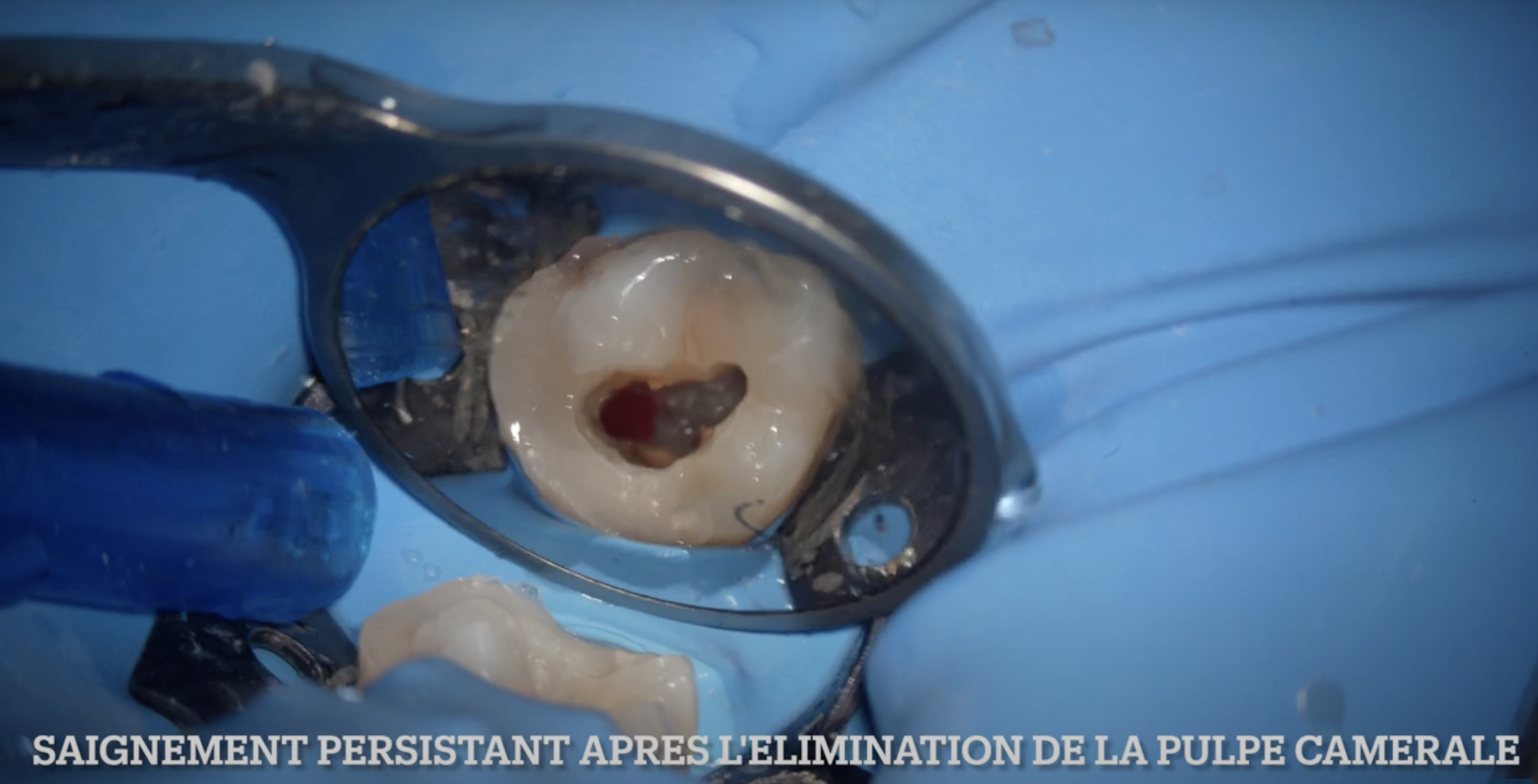
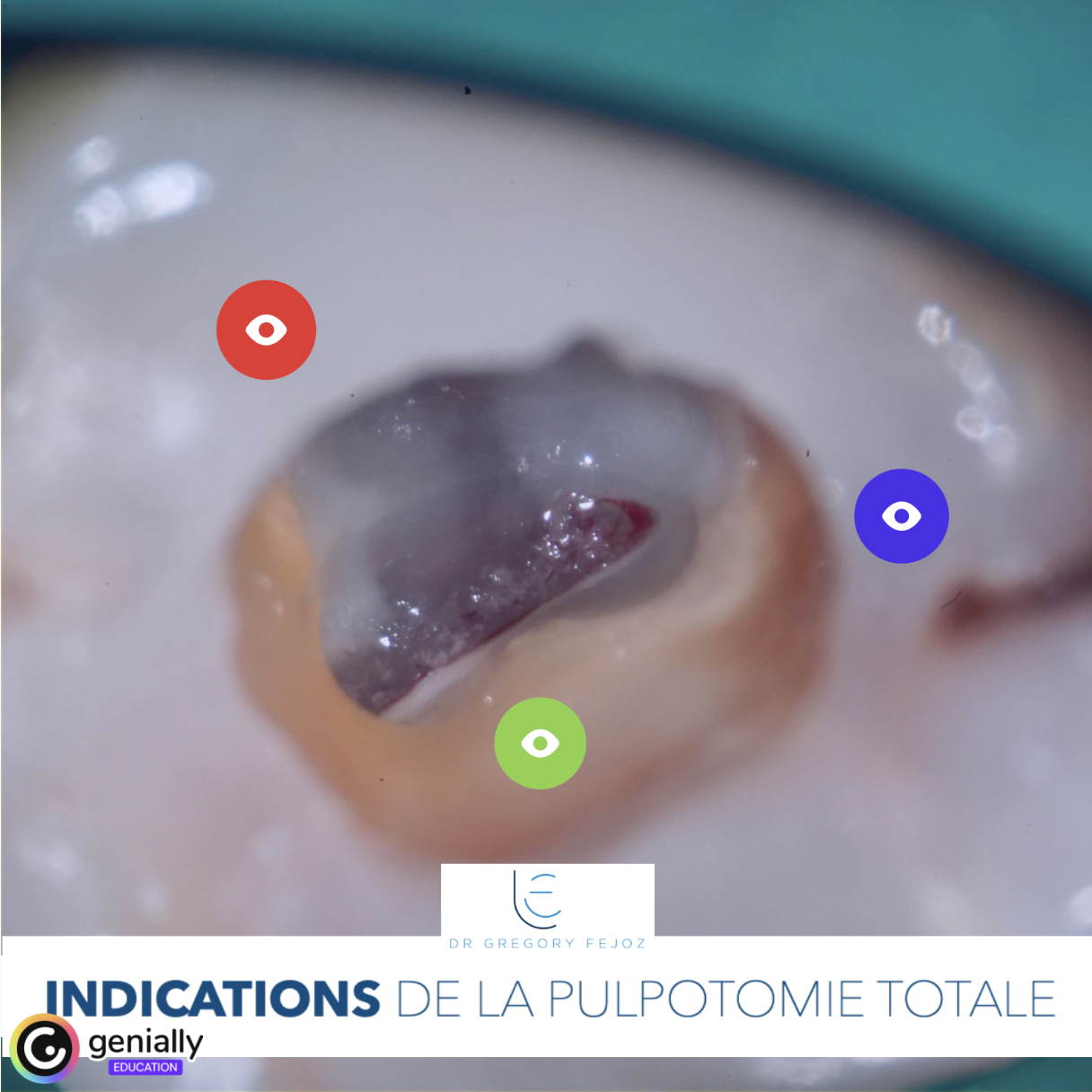
🔬 L’étude :
Islam MR et al. Emerging trends of injectable hydrogels for vital pulp therapy: A comprehensive review. Int Endod J. 2025;00:1–39. doi:10.1111/iej.14279
Pourquoi ça nous intéresse ?
Les thérapies de maintien de la vitalité pulpaire évoluent rapidement. Si les matériaux classiques comme le MTA, la Biodentine ou les ciments mixte ont permis de sauver des milliers de pulpes, ils présentent encore des limites :
- prise lente,
- risque de décoloration,
- absence de stimulation biologique optimisée,
- manipulation parfois complexe.
Les hydrogels injectables apparaissent comme des candidats prometteurs pour dépasser ces freins.
Comment fabrique-t-on un hydrogel ?
Un hydrogel injectable est un polymère hydrophile qui passe d’un état liquide (sol) à un état gélifié (gel) une fois injecté dans la cavité.
- Polymères naturels : acide hyaluronique, gélatine, collagène, chitosane… très biocompatibles et biodégradables.
- Polymères synthétiques : PEG, PVA… plus stables et modulables.
- Hydrogels hybrides : mélange naturel + synthétique, auxquels on ajoute des nanoparticules, peptides, facteurs de croissance, cellules souches.
La gélification peut se faire par :
- réactions chimiques (ex. photo-polymérisation, click chemistry),
- ou stimuli physiques (changement de température, pH, ions).
Résultat : un biomatériau injectable, adaptable, bioactif, qui peut servir de réservoir pour guider la cicatrisation.
Résultats des études précliniques
Les modèles in vitro et animaux montrent :
- Réduction de l’inflammation grâce à l’effet anti-ROS et à la modulation immunitaire.
- Stimulation de la différenciation odontoblastique (augmentation de l’expression de DSPP, DMP1, ALP, OCN).
- Formation d’une dentine réparatrice homogène avec tubules organisés, proche de la dentine primaire.
- Angiogenèse accrue via la libération progressive de VEGF ou autres facteurs pro-angiogéniques.
- Effet antimicrobien démontré contre S. mutans, L. casei et A. naeslundii dans certaines formulations.
Bref : les hydrogels injectables cicatrisent mieux, régénèrent mieux et protègent mieux que les matériaux traditionnels.
Les limites actuelles
Malgré leurs promesses, les hydrogels injectables restent au stade expérimental. Les preuves disponibles proviennent surtout d’études en laboratoire ou sur animaux, avec peu de données cliniques humaines et un manque de suivi à long terme. De plus, la diversité des formulations utilisées rend difficile toute comparaison et empêche la standardisation.
Des questions de sécurité persistent également : certains composants peuvent être cytotoxiques et la dégradation de l’hydrogel pourrait libérer des sous-produits indésirables. Enfin, leur fabrication complexe, leur coût élevé et les contraintes de stockage limitent encore leur application en cabinet. En somme, il faudra des études cliniques robustes, des formulations standardisées et une simplification technique avant d’envisager une utilisation quotidienne. Le chemin reste encore long.
Ce qu’il faut surveiller pour demain
- Hydrogels intelligents : libération contrôlée de biofacteurs, intégration de nanotechnologies.
- Essais cliniques randomisés pour valider les résultats précliniques.
- Protocoles simplifiés pour une utilisation accessible au fauteuil.
Le message clé
Les hydrogels injectables ne sont pas encore sur nos plateaux cliniques, mais ils annoncent une révolution biologique dans le domaine de la préservation pulpaire : un matériau sur-mesure, actif et régénératif, au service de la préservation pulpaire. Ce serait le top non ?
Bonne semaine a tous.
#endolight